MICROBIOTE INTESTINAL : Il influe sur les vaisseaux du cerveau jusqu'au risque d'AVC
C’est une nouvelle démonstration de l’influence du microbiote intestinal sur la santé cérébrale et, dans le cas d’espèce, sur le risque de malformations pouvant entraîner un accident vasculaire cérébral ou une épilepsie. Cette recherche, publiée dans Nature, ajoute à la preuve de plus en plus conséquente du lien entre microbes intestinaux et troubles du système nerveux, avec l’idée de pouvoir intervenir sur le microbiote de manière à traiter certaines de ces malformations cérébrales.
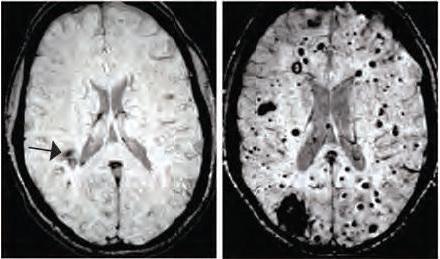
Ces dernières semaines, on ne compte plus les études qui documentent cet interface microbiote intestinal- cerveau. Une étude récente a apporté une démonstration imparable, chez la souris : greffer « du » microbiote humain d'un sujet atteint du syndrome du côlon irritable entraîne chez l'animal, non seulement le développement des mêmes symptômes intestinaux mais également un comportement qui reflète l'agitation et l'anxiété. La stimulation électromagnétique du cerveau peut également modifier la composition du microbiote intestinal. Enfin, des chercheurs de l'Université de York ont également montré que l'augmentation des niveaux alimentaires du neurotransmetteur inhibiteur, l'acide gamma-aminobutyrique (GABA), pouvait influencer les réponses neuronales aux stimuli sensoriels basiques. Enfin des chercheurs de l'Université de Californie – Los Angeles (UCLA) ont montré chez des patients atteints du syndrome du côlon irritable, l'association entre les microbes intestinaux et la structure du cerveau. Cette nouvelle étude suggère que le microbiote intestinal peut influencer la structure des vaisseaux sanguins du cerveau jusqu'au risque d'AVC ou d'épilepsie. Les malformations caverneuses cérébrales (MCC) – visuel de droite- sont des grappes de vaisseaux sanguins dilatés et à paroi mince qui peuvent entrainer des convulsions ou des accidents vasculaires cérébraux en cas de fuites de sang dans le tissu cérébral environnant.
Des changements dans le microbiote peuvent affecter la progression d'un trouble causé par une mutation génétique : cette équipe de scientifiques de l'Université de Pennsylvanie étudie ici les mécanismes qui provoquent la formation de ces hémangiomes chez des souris génétiquement modifiées et identifient ainsi un lien inattendu avec les bactéries intestinales. Lorsque certaines bactéries sont éliminées, le nombre de lésions diminue en effet considérablement. Les chercheurs ont développé des souris modèles de MCC, les ont transférées dans un nouvel environnement, et constatent que la formation des lésions est presque réduite à zéro - une variabilité dans la formation des lésions également observée chez les humains, où les patients porteurs de la même mutation génétique suivent souvent une évolution pathologique radicalement différente-. Cherchant à cerner la cause de cette variabilité soudaine, les scientifiques remarquent que les quelques souris qui continuent à former des lésions ont développé des abcès bactériens dans leur abdomen. Ces abcès contiennent des bactéries Gram négatives. Lorsque les chercheurs induisent volontairement ces infections bactériennes chez des animaux modèles de MCC, la moitié développe des lésions cérébrales significatives. Ces souris présentent également des abcès dans la rate, ce qui suggère que les bactéries intestinales sont entrées dans la circulation sanguine à partir du site d'abcès de départ. Il y a donc connexion ou propagation de l'intestin, à la rate et au cerveau via le flux sanguin. Et cette propagation entraine la formation de ces lésions vasculaires dans le cerveau.
Mais comment les bactéries dans le sang peuvent-elles influencer le comportement des vaisseaux sanguins dans le cerveau ? Les bactéries Gram négatives produisent des molécules appelées lipopolysaccharides (LPS) qui sont des activateurs puissants de la signalisation immunitaire innée. Lorsque les souris reçoivent des injections de LPS, elles développent des MCC semblables à celles induites par une infection bactérienne. À l'inverse, lorsque les chercheurs « désactivent » 2 récepteurs LPS et TLR4, les souris ne développent plus de lésions MCC. Les chercheurs constatent également que, chez l'Homme, les mutations génétiques provoquant une augmentation de l'expression de TLR4 sont bien associées à un risque accru de formation de MCC. Ainsi, en synthèse, la formation de lésions cérébrales peut être favorisée par des bactéries Gram négatives dans le corps grâce à la signalisation LPS.
Prévenir ces lésions cérébrales en changeant les bactéries du microbiote ? Lorsque les souris modèles de MCC sont élevées ès la naissance dans des conditions exemptes de germes ou sont traitées par antibiotiques afin de « réinitialiser » leur microbiome, le nombre de lésions est considérablement réduit, ce qui confirme que le microbiome intestinal influence la formation de MCC. Et lorsque les chercheurs donnent à ces mêmes souris modèles de MCC un médicament qui bloque spécifiquement TLR4, la formation de ces lésions est considérablement réduite. -De surcroît, ce fameux médicament utilisé pour bloquer le TLR4 a déjà été testé chez les patients pour d'autres affections, et pourrait présenter un potentiel thérapeutique dans le traitement des MCC…-
La relation entre le microbiome et la formation de ces lésions cérébrales liées à une mutation génétique, apporte une nouvelle preuve du lien microbiote -cerveau, ici chez des animaux modèles de malformations caverneuses cérébrales. L'idée est donc à nouveau d'intervenir sur le microbiome pour « soigner » le cerveau.
Autres actualités sur le même thème
BILINGUISME: Il favorise le développement de la concurrence cognitive
Actualité publiée il y a 8 années 2 moisTUMEUR au CERVEAU : Il joue du saxophone pendant l’intervention
Actualité publiée il y a 6 années 7 moisBURN OUT : Un simple patch pour le détecter
Actualité publiée il y a 3 années 2 moisPERTE d’EMPLOI : Le rappel d’un mal-être profond chez les hommes d’âge moyen
Actualité publiée il y a 4 années 6 mois




