AXE INTESTIN-CERVEAU : Entérocolite nécrosante et lésions cérébrales, un lien certain chez le prématuré

Cette étude de chercheurs de la Johns Hopkins Medicine et de l’Université de Lausanne nous apporte un nouvel exemple de l’axe intestin-cerveau : il s’agit d’un lien entre les maladies intestinales et les lésions cérébrales chez les prématurés. L’équipe décrypte, dans la revue Science Translational Medicine et sur une souris modèle, comment des lymphocytes T associés à l'entérocolite nécrosante (NEC) du prématuré s’attaquent à la myéline, la gaine qui protège les cellules nerveuses dans le cerveau.
L’entérocolite nécrosante (NEC) touche environ 12% des nourrissons de faible poids de naissance. La NEC est une urgence gastro-intestinale à évolution rapide dans laquelle des bactéries envahissent la muqueuse intestinale et provoquent une inflammation qui peut finalement détruire les tissus sains de l’intestin. Lorsque la maladie tue un grand nombre de cellules intestinales (cellules nécrotiques), les bactéries peuvent fuir à travers la paroi intestinale, pénétrer dans la circulation sanguine et provoquer une septicémie mettant la vie en danger.
Les médecins savent depuis longtemps que la NEC est souvent liée au développement de lésions cérébrales sévères chez les nourrissons qui survivent. Cependant le processus par lequel l'intestin malade « s’attaque » au cerveau du nouveau-né restait mal compris.
Un type de cellule immunitaire qui voyage de l'intestin au cerveau
Cette étude fait suite à une précédente recherche de la même équipe, en 2018, menée également sur des souris et qui montrait que les animaux atteints de NEC fabriquent une protéine appelée TLR4 qui se lie aux bactéries dans l'intestin et précipite la destruction intestinale. La recherche montrait également que TLR4 active simultanément les cellules immunitaires dans le cerveau appelées microglies, entraînant une perte de substance blanche, des lésions cérébrales et une diminution de la fonction cognitive.
L’équipe identifie ici un type de cellule du système immunitaire qui voyage de l'intestin au cerveau et attaque les cellules plutôt que de les protéger comme ces cellules devraient le faire normalement. Les chercheurs ont émis l'hypothèse que les lymphocytes T CD4 + - des cellules du système immunitaire également appelées cellules T auxiliaires - pouvaient constituer ce lien. Les cellules T CD4 + sont qualifiées « d’auxiliaires » car elles soutiennent un autre type de cellule immunitaire appelé lymphocyte B (ou cellule B) dans leurs réponses aux protéines de surface - antigènes - sur les cellules infectées par des envahisseurs étrangers tels que des bactéries ou des virus. Activées par les lymphocytes T CD4 +, les lymphocytes B immatures deviennent soit des plasmocytes qui produisent des anticorps pour marquer les cellules infectées en vue de leur élimination, soit des cellules mémoire qui «se souviennent» de l'antigène pour une réponse plus rapide lors de futures invasions.
Les cellules T CD4 + envoient également des messagers chimiques qui amènent un autre type de cellules T - connu sous le nom de cellules T tueuses - dans la zone infectée afin que les cellules infectées ciblées puissent être éliminées. Cependant, si cette activité se produit à un mauvais site ou au mauvais moment, les signaux peuvent par inadvertance induire les lymphocytes T tueurs à attaquer les cellules saines.
Sur des souris « néonatales » modèles de NEC, les chercheurs montrent que leurs cerveaux présentent des accumulations de lymphocytes T CD4 + ainsi qu’une activité microgliale accrue. Ces cellules T proviennent des régions intestinales enflammées par la NEC. Ces souris modèles de NEC présentent également une barrière hémato-encéphalique affaiblie : cela pourrait, selon les chercheurs, expliquer comment les cellules T CD4 + de l'intestin atteignent le cerveau. Enfin, l'accumulation de cellules T CD4 + apparaît être la cause de la lésion cérébrale observée avec la NEC. Car lorsque les chercheurs bloquent biologiquement le mouvement des cellules T auxiliaires dans le cerveau, ou encore neutralisent les cellules T en les liant à un anticorps spécialement conçu, l'activité microgliale est atténuée et la substance blanche dans le cerveau (myéline) est préservée.
Quel processus ? Pour mieux définir le rôle des cellules T CD4 + dans les lésions cérébrales, les chercheurs ont récolté des cellules T dans le cerveau de souris atteintes de NEC et les ont injectées dans le cerveau de souris élevées pour manquer de lymphocytes T et B. Ces souris ayant reçu les lymphocytes présentent alors des niveaux plus élevés de signaux chimiques qui attirent les lymphocytes T tueurs. Les chercheurs constatent alors une activation de la microglie, une inflammation du cerveau et la perte de substance blanche soit un ensemble de marqueurs de lésions cérébrales.
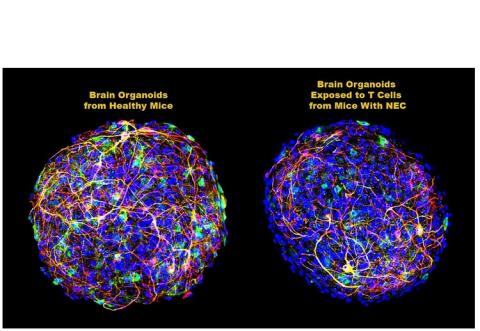
Sur des organoïdes et des cellules cérébrales de souris cultivées en laboratoire pour simuler l'ensemble du cerveau, l’ajout de cellules T CD4 + dérivées du cerveau de souris atteintes de NEC induit l’augmentation d’un signal chimique spécifique des cellules T - une cytokine (protéine inflammatoire) connue sous le nom d'interféron-gamma (IFN-gamma). L’ajout d’IFN-gamma aux organoïdes induit également des niveaux accrus d'inflammation et une destruction de la myéline. En revanche, un anticorps neutralisant l’IFN-gamma, permet de réduire la production de cytokines donc l'inflammation et de restaurer, partiellement, la substance blanche.
L’interféron gamma dirige le processus menant aux lésions cérébrales liées à la NEC. Une découverte d’ailleurs appuyée par le constat de niveaux plus élevés d'IFN-gamma dans les tissus cérébraux de souris modèles de NEC.
Enfin, le séquençage génétique des lymphocytes T dérivés du cerveau et de l'intestin provenant de souris avec et sans NEC montre que les séquences des cellules T auxiliaires de souris atteintes de NEC, en moyenne, sont génétiquement similaires à 25% (vs 2% chez les souris sans NEC).
Dans une dernière expérience, lorsque les chercheurs bloquent l'IFN-gamma, cela entraîne une protection significative contre le développement de lésions cérébrales chez les souris atteintes de NEC sévère.
C’est donc l’espoir d’une approche thérapeutique pour les nourrissons prématurés atteints de la maladie.
« Nos recherches suggèrent fortement que les cellules T auxiliaires des intestins enflammés par la NEC peuvent migrer vers le cerveau et causer ces dommages », explique l’auteur principal, le Dr Hackam, Pr de chirurgie à la Johns Hopkins : « Nous pensons donc que les lésions cérébrales liées à la NEC se développent chez les nourrissons prématurés par le même mécanisme ».
Autres actualités sur le même thème
MICROBIOTE INTESTINAL : Ces bonnes bactéries qui aiment le sucre
Actualité publiée il y a 11 mois 19 heuresHYPERTENSION : La méditation transcendantale évite l'hyperthrophie ventriculaire
Actualité publiée il y a 6 années 2 semainesMÉMOIRE: Comment les grands moments de la vie font des flashbulb memories
Actualité publiée il y a 9 années 4 moisÉPILEPSIE: Engraisser le cerveau pour engluer les crises
Actualité publiée il y a 9 années 3 mois




